Galvaniska Celler: En Detaljerad Labbrapport
Introduktion
Denna labbrapport utforskar principen bakom galvaniska celler, även kända som voltaiska celler. Dessa celler omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. Syftet med detta experiment är att bygga och analysera olika galvaniska celler, för att förstå hur olika metaller och elektrolyter påverkar cellens spänning.
Vi kommer att fokusera på att förklara de grundläggande koncepten, genomföra experiment och analysera resultaten på ett tydligt och detaljerat sätt. Vi kommer att undersöka olika kombinationer av metaller och elektrolyter, och dokumentera de resulterande spänningarna. Vi kommer även att undersöka hur koncentrationer påverkar den elektriska potentialen.
Teori
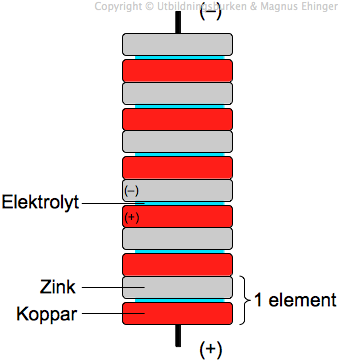
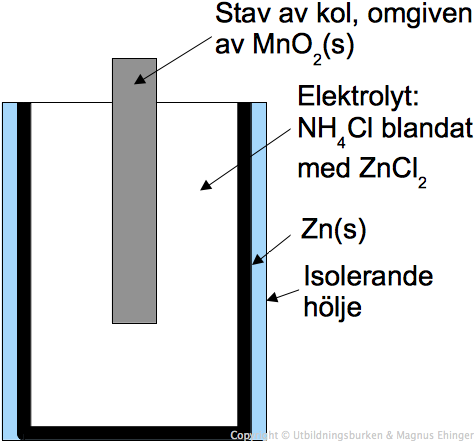
En galvanisk cell består av två halvceller, var och en innehållande en elektrod i en elektrolytlösning. I en halvcell sker en oxidation (förlust av elektroner) och i den andra en reduktion (vinst av elektroner). Elektronerna flödar från den oxiderande elektroden (anoden) till den reducerande elektroden (katoden) genom en extern krets, vilket skapar en elektrisk ström.
En saltbrygga används för att upprätthålla elektrisk neutralitet i halvcellerna genom att tillåta joner att flöda mellan dem. Denna ström av joner förhindrar att laddningar byggs upp i lösningarna, vilket skulle stoppa reaktionen.
Den elektriska potentialen (spänningen) hos en galvanisk cell kan beräknas med hjälp av standardreduktionspotentialer för de involverade halvcellerna. Denna potential, som kallas cellpotentialen, är skillnaden mellan potentialerna för katoden och anoden. Den beräknas med formeln: $$E_{cell} = E_{cathode} – E_{anode}$$.
En känd typ av galvanisk cell är Daniellcellen, som består av en zinkelektrod i en zinksulfatlösning och en kopparelektrod i en kopparsulfatlösning. Denna cell genererar en relativt hög spänning och används ofta som ett exempel i undervisningen.
Material och Metod

Material
- Kopparplåt (Cu)
- Zinkplåt (Zn)
- Järnplåt (Fe)
- Kopparsulfatlösning (CuSO4)
- Zinksulfatlösning (ZnSO4)
- Järnsulfatlösning (FeSO4)
- Kaliumnitratlösning (KNO3) för saltbrygga
- U-rör (för saltbrygga)
- Voltmeter
- Bägare
- Sladdar med krokodilklämmor
Metod
- Förbered halvcellerna genom att placera metallplåtarna i respektive elektrolytlösningar.
- Konstruera en saltbrygga genom att fylla ett U-rör med kaliumnitratlösning och täta ändarna med bomull.
- Placera saltbryggan mellan bägarna med elektrolytlösningarna.
- Anslut metallplåtarna till voltmetern med hjälp av sladdar och krokodilklämmor.
- Mät och notera den resulterande spänningen.
- Upprepa experimentet med olika kombinationer av metaller och elektrolyter.
- Variera koncentrationen av elektrolyterna och dokumentera hur spänningen förändras.

Resultat
Tabell över uppmätta cellpotentialer för olika kombinationer av metaller och elektrolyter:
| Zn/ZnSO4 | Cu/CuSO4 | [Uppmätt Värde] |
| Fe/FeSO4 | Cu/CuSO4 | [Uppmätt Värde] |
| Zn/ZnSO4 | Fe/FeSO4 | [Uppmätt Värde] |
Diagram som visar hur cellpotentialen påverkas av koncentrationen av elektrolyterna.
Beskrivning av observationer, som eventuell utfällning eller gasbildning.
Analys och Diskussion
Analys av resultaten i förhållande till standardreduktionspotentialer. Diskussion om eventuella avvikelser och möjliga felkällor. Förklaring av hur koncentrationen påverkar cellpotentialen enligt Nernst ekvation.
Diskussion om redoxreaktionerna som sker i varje halvcell och hur dessa bidrar till den totala cellpotentialen. Förklaring av saltbryggans funktion och dess betydelse för att upprätthålla en kontinuerlig ström.
Jämförelse mellan teoretiska och uppmätta värden, och diskussion om eventuella skillnader. Förklaring av hur experimentella fel kan ha påverkat resultaten.
Slutsats
Sammanfattning av de viktigaste resultaten och slutsatserna från experimentet. Bekräftelse av hypotesen om hur olika metaller och elektrolyter påverkar cellpotentialen. Förslag på vidare experiment för att fördjupa förståelsen av galvaniska celler.
Copyright © [Ditt Namn/År]