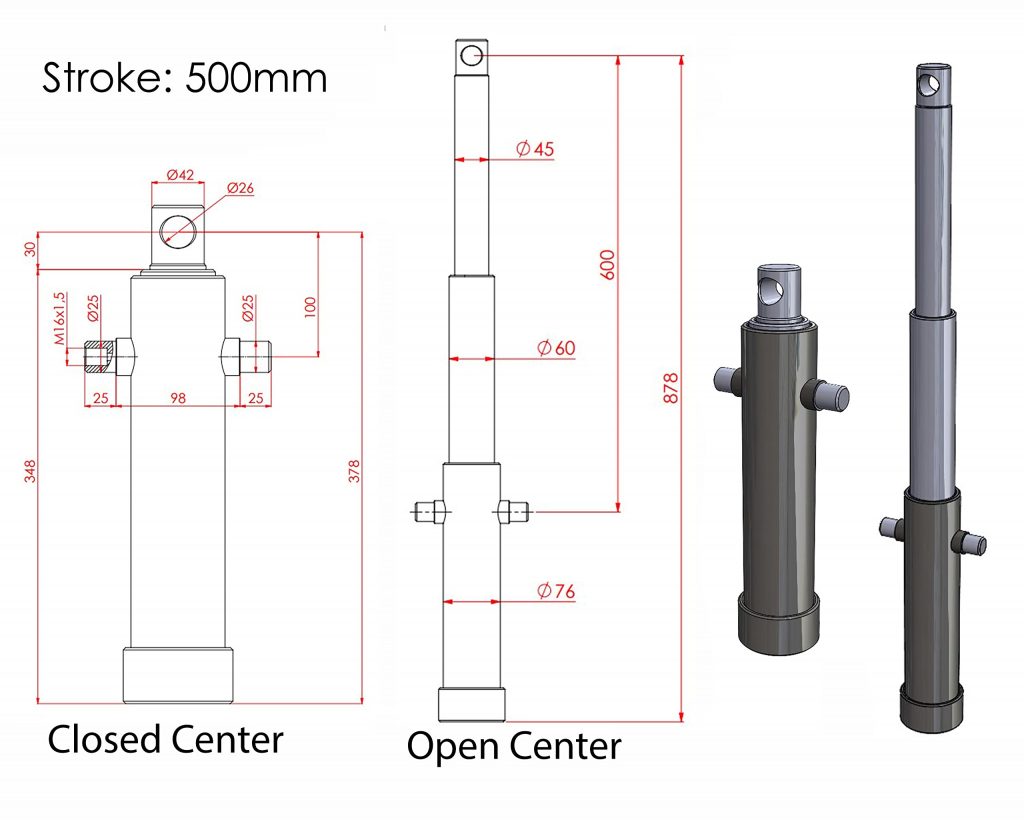
Galvaniska Strömmar: Koppar och Rostfritt Stål – En Djupgående Analys
När två olika metaller, som koppar och rostfritt stål, kommer i kontakt i en elektrolyt, kan de skapa en galvanisk cell. Detta fenomen, känt som galvanisk korrosion, är ett viktigt område inom materialvetenskap och elektrokemi. Denna artikel utforskar de underliggande mekanismerna, konsekvenserna och förebyggande åtgärderna relaterade till galvaniska strömmar mellan koppar och rostfritt stål.
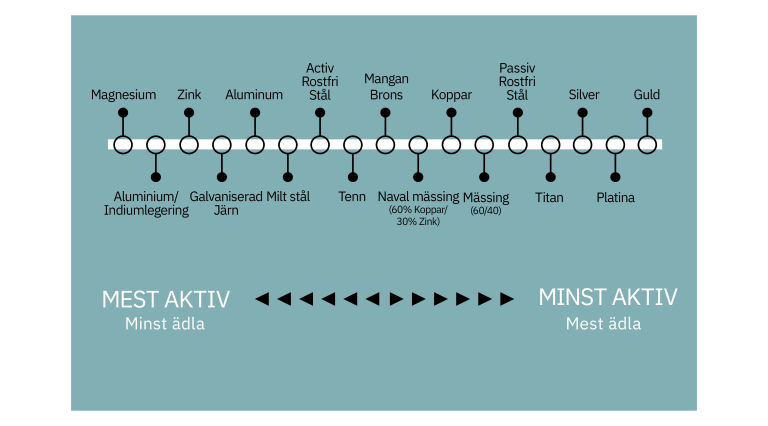
Vad är Galvanisk Korrosion?
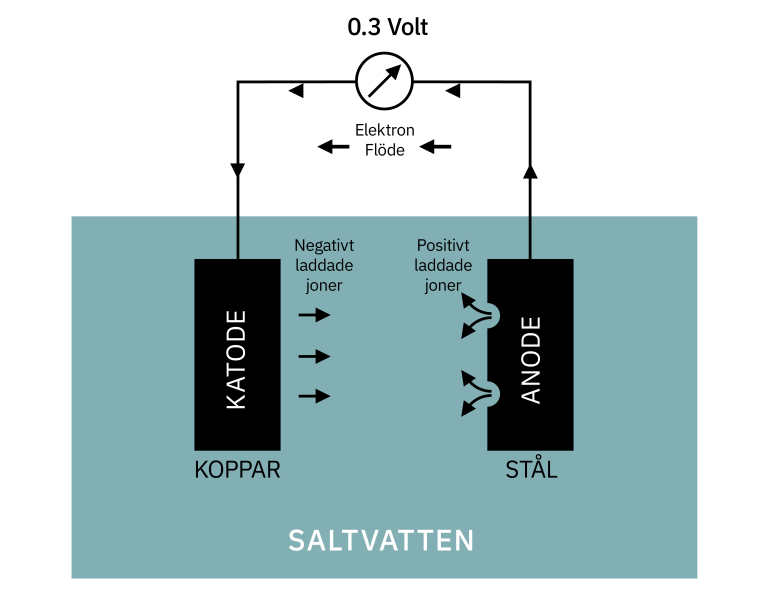
Galvanisk korrosion uppstår när två olika metaller (eller legeringar) med olika elektrokemiska potentialer är elektriskt anslutna i en elektrolyt. Elektrolyten kan vara vatten, fuktig luft, jord eller en annan ledande lösning. Denna kombination skapar en galvanisk cell, där en metall fungerar som en anod (där oxidation sker) och den andra som en katod (där reduktion sker). Koppar och rostfritt stål har olika potentialer, vilket gör dem mottagliga för galvanisk korrosion när de kombineras.
Mekanismen Bakom Galvaniska Strömmar
För att förstå processen måste vi titta på de elektrokemiska potentialerna. Koppar har en högre ädelhet än många typer av rostfritt stål. Detta innebär att koppar tenderar att fungera som katod och rostfritt stål som anod i en galvanisk cell. Som ett resultat kommer rostfritt stål att korrodera snabbare än det skulle göra ensamt, medan koppar skyddas.
Elektrolytens Roll
Elektrolyten spelar en avgörande roll i processen. Ju mer ledande elektrolyten är, desto snabbare sker korrosionen. Saltvatten, till exempel, är en mycket effektiv elektrolyt och kan kraftigt öka korrosionshastigheten. Även fuktig luft kan fungera som en elektrolyt, om än långsammare.
Anod- och Katodreaktioner
- Anod (Rostfritt Stål): Metallen oxideras, vilket innebär att den förlorar elektroner och korroderar.
- Katod (Koppar): Metallen reduceras, vilket innebär att den tar upp elektroner och skyddas.
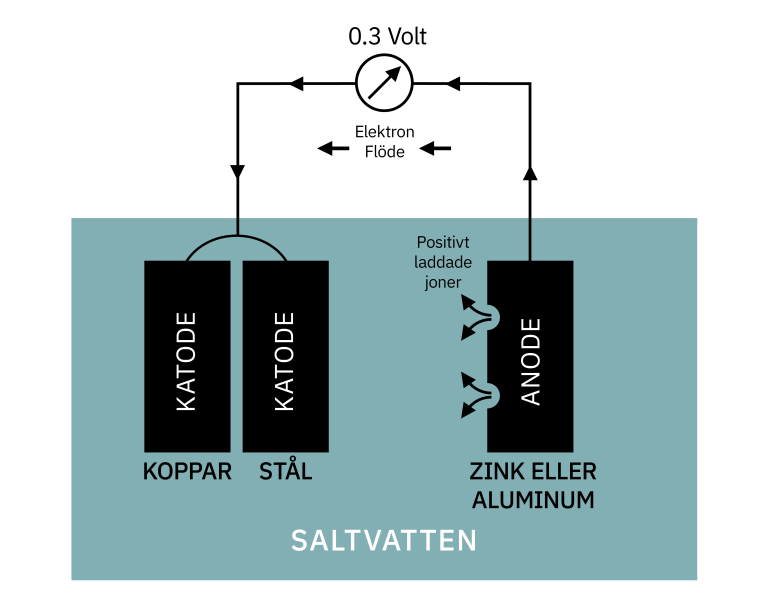
Konsekvenser av Galvanisk Korrosion
De potentiella konsekvenserna av galvanisk korrosion kan vara allvarliga, särskilt i kritiska tillämpningar som marina miljöer, rörledningar och strukturella komponenter. Korrosion kan leda till strukturell svaghet, läckage och systemfel, vilket i sin tur kan orsaka kostsamma reparationer och säkerhetsrisker.
Exempel på Användningsområden
- Marina Tillämpningar: Propellrar, skrov och rörsystem.
- VVS-system: Rör och kopplingar.
- Elektriska Installationer: Jordning och ledningar.
- Industriella Anläggningar: Värmeväxlare och tankar.
Förebyggande Åtgärder
För att minimera risken för galvanisk korrosion är det viktigt att vidta förebyggande åtgärder. Här är några effektiva strategier:
Materialval
Välj metaller med liknande elektrokemiska potentialer. Om detta inte är möjligt, försök att minimera kontaktytan mellan de olika metallerna.

Isolering
Isolera metallerna från varandra med icke-ledande material som gummi, plast eller teflon. Detta förhindrar elektrisk kontakt och därmed galvanisk ström.
Skyddande Beläggningar
Applicera skyddande beläggningar som färg, epoxi eller metallplätering. Dessa beläggningar skapar en barriär mellan metallerna och elektrolyten.
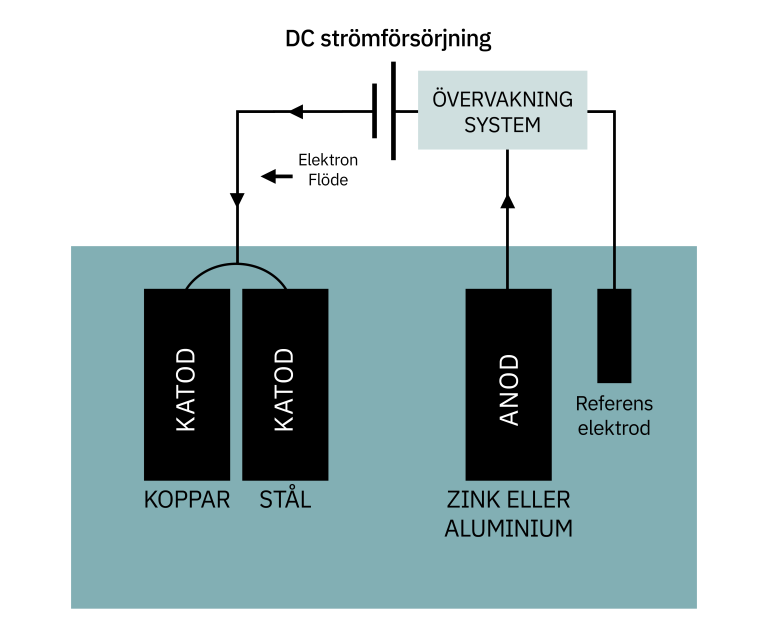
Katodiskt Skydd
Använd katodiskt skydd genom att ansluta en offeranod (en metall som är mer anodisk än rostfritt stål) till strukturen. Offeranoden korroderar i stället för rostfritt stål.
Designöverväganden
Designa systemet så att vatten eller elektrolyt inte samlas mellan metallerna. Undvik spalter och håligheter där fukt kan stanna kvar.
Avslutande Tankar
Förståelsen av galvaniska strömmar mellan koppar och rostfritt stål är avgörande för att säkerställa långvarig hållbarhet och prestanda i olika tillämpningar. Genom att tillämpa lämpliga förebyggande åtgärder kan man minimera risken för korrosion och förlänga livslängden på metalliska komponenter. Genom att välja rätt material och använda isolering eller skyddande beläggningar kan man effektivt hantera dessa problem. Genom att tillämpa dessa strategier kan man säkerställa att system och strukturer förblir robusta och tillförlitliga över tid.