Det Fascinerande Galvaniska Elementet Zink-Koppar
En utforskning av den klassiska Daniellcellen och dess betydelse inom elektrokemi.
Vad är ett Galvaniskt Element?
Ett galvaniskt element, även känt som en voltaisk cell, är en anordning som omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. I hjärtat av denna process finns två olika metaller som agerar som elektroder, nedsänkta i en elektrolytlösning.
Det galvaniska elementet zink-koppar, ofta kallat Daniellcellen, är ett av de mest kända och studerade exemplen. Det ger en tydlig förståelse för hur elektrisk ström genereras genom kemiska reaktioner.
Komponenter och Funktion
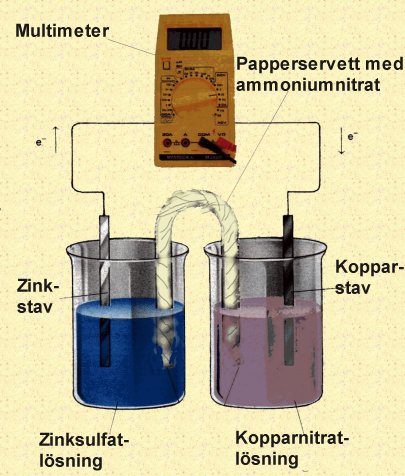
Daniellcellen består av följande viktiga komponenter:
- Zinkelektrod (Anod): En zinkstav nedsänkt i en zinksulfatlösning (ZnSO4).
- Kopparelektrod (Katod): En kopparstav nedsänkt i en kopparsulfatlösning (CuSO4).
- Saltbrygga: En U-formad rör fyllt med en elektrolyt, till exempel kaliumklorid (KCl), som förbinder de två lösningarna.
- Extern krets: En ledare som förbinder zink- och kopparelektroderna, vilket möjliggör flödet av elektroner.

Funktionen hos Daniellcellen bygger på följande redoxreaktioner:
- Anodreaktion (Oxidation): Zinkatomer avger elektroner och omvandlas till zinkjoner: Zn(s) → Zn2+(aq) + 2e-
- Katodreaktion (Reduktion): Kopparjoner tar upp elektroner och omvandlas till kopparatomer: Cu2+(aq) + 2e- → Cu(s)
- Totalreaktion: Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Elektronerna som frigörs vid zinkelektroden flödar genom den externa kretsen till kopparelektroden, vilket skapar en elektrisk ström. Saltbryggan säkerställer att laddningsbalansen upprätthålls genom att tillåta joner att flöda mellan de två lösningarna.
Potentialskillnad och Elektromotorisk Kraft (EMK)
Potentialskillnaden mellan zink- och kopparelektroderna, känd som den elektromotoriska kraften (EMK), bestämmer cellens spänning. För Daniellcellen är standardpotentialen cirka 1,1 V. Denna potential beror på skillnaden i reduktionspotential mellan zink och koppar.
Den elektromotoriska kraften kan beräknas med hjälp av Nernst-ekvationen, som tar hänsyn till koncentrationerna av jonerna i lösningarna.
Praktiska Tillämpningar
Även om Daniellcellen är en klassisk demonstration av galvaniska element, har den ersatts av mer effektiva batterier i moderna tillämpningar. Principen bakom Daniellcellen är dock grundläggande för förståelsen av alla typer av batterier och elektrokemiska processer.
Galvaniska element används i:
- Batterier: Olika typer av batterier, som bly-syra-batterier och litiumjonbatterier, bygger på samma principer som Daniellcellen.
- Korrosionsskydd: Galvanisering, där ett tunt lager av zink appliceras på järn eller stål, skyddar mot korrosion genom att fungera som en offeranod.
- Elektroplätering: Galvaniska processer används för att belägga metaller med andra metaller, vilket förbättrar deras utseende och skyddar dem mot korrosion.
- Elektrokemisk analys: Galvaniska element används i olika analytiska tekniker för att bestämma koncentrationer av joner i lösningar.
Slutsats
Det galvaniska elementet zink-koppar, eller Daniellcellen, är en grundläggande och viktig anordning inom elektrokemi. Genom att omvandla kemisk energi till elektrisk energi, ger det en tydlig förståelse för redoxreaktioner och deras praktiska tillämpningar. Genom att förstå principen bakom Daniellcellen, kan vi bättre förstå hur batterier och andra elektrokemiska system fungerar.
Denna kunskap är avgörande för att utveckla nya och mer effektiva energilagringslösningar och för att förbättra olika industriella processer.