Galvaniska Element Laboration: En Djupdykning i Elektrokemi
Välkommen till en detaljerad utforskning av galvaniska element genom en praktisk laboration. Denna artikel är utformad för att ge dig en djupare förståelse för elektrokemi, redoxreaktioner och hur du kan bygga dina egna batterier. Oavsett om du är student eller en kemientusiast, kommer denna guide att ge dig värdefull kunskap och praktiska färdigheter.
Vad är ett Galvaniskt Element?
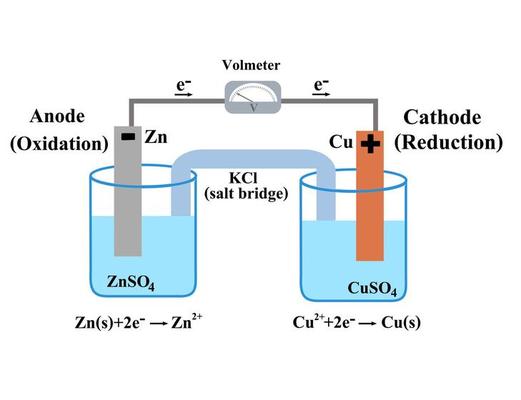
Ett galvaniskt element, även känt som ett voltaiskt element, är en elektrokemisk cell som omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. Dessa reaktioner sker vid två elektroder, en anod och en katod, som är nedsänkta i en elektrolyt.
Grundläggande Komponenter
- Anod: Elektroden där oxidation sker (förlust av elektroner).
- Katod: Elektroden där reduktion sker (vinst av elektroner).
- Elektrolyt: En lösning som innehåller joner och möjliggör jonflöde mellan elektroderna.
- Saltbrygga: En komponent som förhindrar laddningsuppbyggnad och upprätthåller elektrisk neutralitet.
Laboration: Bygg Ditt Eget Galvaniska Element
Material
- Zinkplåt (Zn)
- Kopparplåt (Cu)
- Zinksulfatlösning (ZnSO₄)
- Kopparsulfatlösning (CuSO₄)
- Saltbrygga (t.ex. pappersremsa indränkt i kaliumnitrat)
- Voltmeter
- Bägare
- Ledningar

Procedur
- Rengör zink- och kopparplåtarna noggrant.
- Häll zinksulfatlösningen i en bägare och kopparsulfatlösningen i en annan.
- Sänk zinkplåten i zinksulfatlösningen och kopparplåten i kopparsulfatlösningen.
- Förbered saltbryggan genom att indränka pappersremsan i kaliumnitratlösningen.
- Placera saltbryggan så att den förbinder de två lösningarna.
- Anslut zinkplåten till voltmeterns negativa pol och kopparplåten till den positiva polen med hjälp av ledningar.
- Mät och notera spänningen.
Resultat och Analys
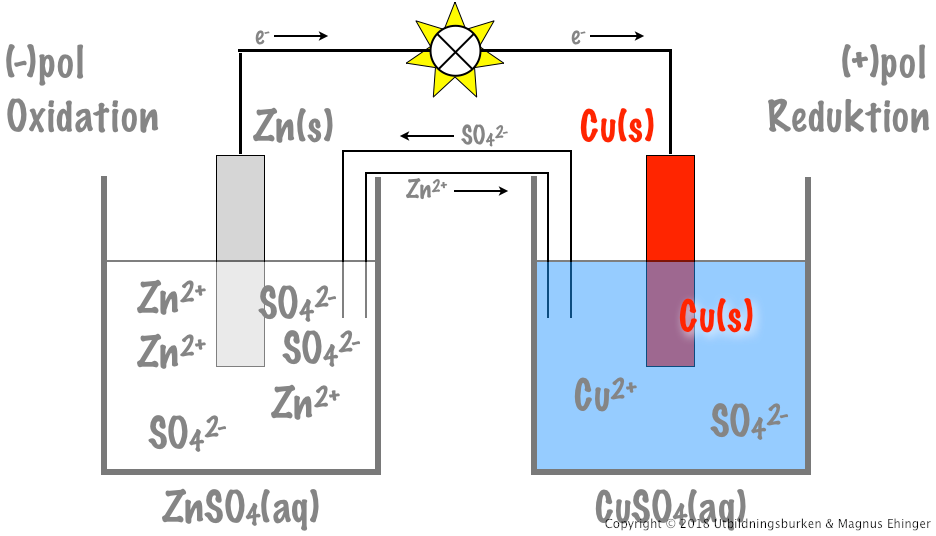
Du kommer att observera en spänning på voltmetern, vilket indikerar att ett galvaniskt element har skapats. Zink fungerar som anod och koppar som katod. Redoxreaktionerna som sker är:
- Anod (oxidation): Zn(s) → Zn²⁺(aq) + 2e⁻
- Katod (reduktion): Cu²⁺(aq) + 2e⁻ → Cu(s)

Saltbryggan möjliggör jonflöde, vilket upprätthåller elektrisk neutralitet och förhindrar att reaktionen avstannar.
Viktiga Begrepp inom Elektrokemi
Redoxreaktioner

Redoxreaktioner (reduktions-oxidationsreaktioner) är grundläggande för funktionen av galvaniska element. Oxidation innebär förlust av elektroner, medan reduktion innebär vinst av elektroner.
Elektrodpotential
Elektrodpotential är ett mått på en elektrods tendens att förlora eller vinna elektroner. Standardelektrodpotentialen mäts under standardförhållanden (298 K, 1 atm, 1 M lösning).
Nernst Ekvation
Nernst ekvation används för att beräkna elektrodpotentialen under icke-standardförhållanden:
$$E = E° – \frac{RT}{nF} \ln Q$$
Där:
- E är elektrodpotentialen
- E° är standardelektrodpotentialen
- R är gaskonstanten
- T är temperaturen
- n är antalet överförda elektroner
- F är Faradays konstant
- Q är reaktionskvoten
Tillämpningar av Galvaniska Element
Galvaniska element har en mängd olika tillämpningar, inklusive:
- Batterier (t.ex. alkaliska batterier, litiumjonbatterier)
- Korrosionsskydd (galvanisering)
- Elektrokemiska sensorer
- Bränsleceller

Slutsats
Genom denna laboration har du fått en praktisk förståelse för galvaniska element och de grundläggande principerna inom elektrokemi. Att bygga ditt eget galvaniska element är ett utmärkt sätt att visualisera och förstå redoxreaktioner och spänningsgenerering. Fortsätt utforska och experimentera för att fördjupa dina kunskaper inom detta fascinerande område.