Galvaniskt Element: En Djupdykning i Elektrokemi
Vad är ett Galvaniskt Element?
Ett galvaniskt element, även känt som ett voltaiskt element, är en elektrokemisk anordning som omvandlar kemisk energi till elektrisk energi. Detta sker genom en spontan redoxreaktion (reduktion-oxidation). I grund och botten är det ett batteri, men termen används ofta mer specifikt för att beskriva de grundläggande mekanismerna bakom batterifunktion.
Hur Fungerar ett Galvaniskt Element?

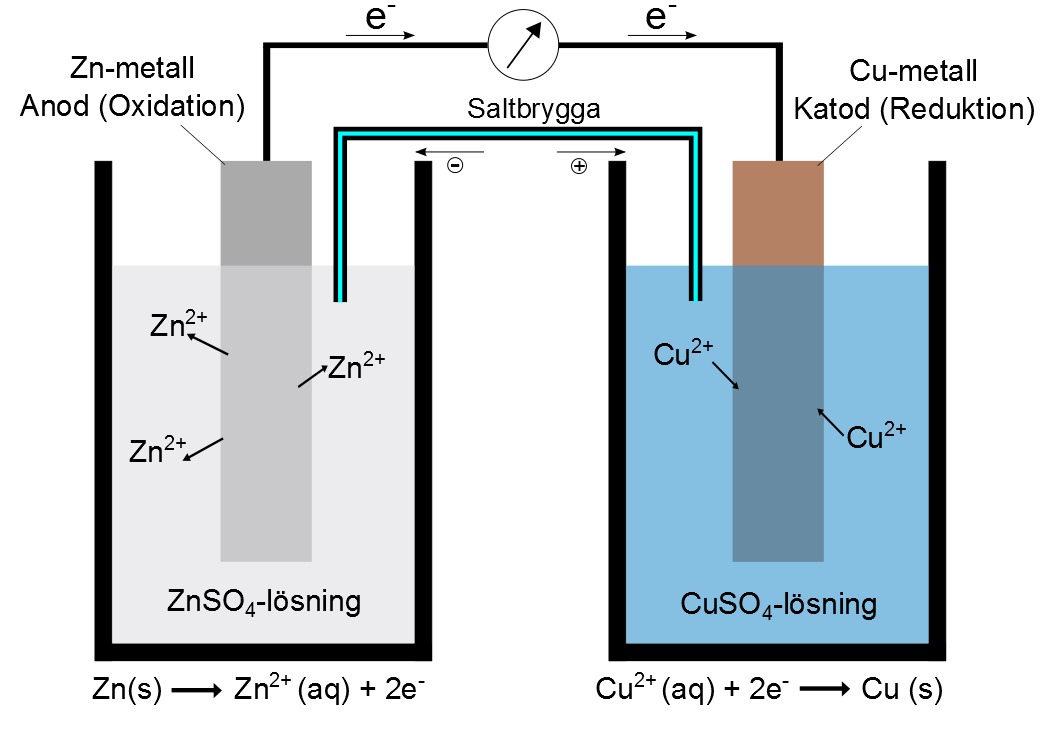
Ett typiskt galvaniskt element består av två olika metaller (elektroder) som är nedsänkta i en elektrolyt, en lösning som innehåller joner. Dessa elektroder är anslutna via en extern krets. Här är de viktigaste komponenterna:
- Anod: Den elektrod där oxidation sker. Metallen i anoden avger elektroner och löses upp i elektrolyten.
- Katod: Den elektrod där reduktion sker. Joner från elektrolyten tar upp elektroner och bildar en fast substans eller gas.
- Elektrolyt: En lösning som innehåller joner och möjliggör jonvandring mellan elektroderna.
- Saltbrygga/Porös Plugg: En anordning som tillåter jonvandring mellan de två elektrolytlösningarna, vilket upprätthåller elektrisk neutralitet.
Denna process skapar en potentialskillnad mellan elektroderna, vilket driver elektroner genom den externa kretsen och genererar elektrisk ström.
Kemiska Reaktioner i ett Galvaniskt Element
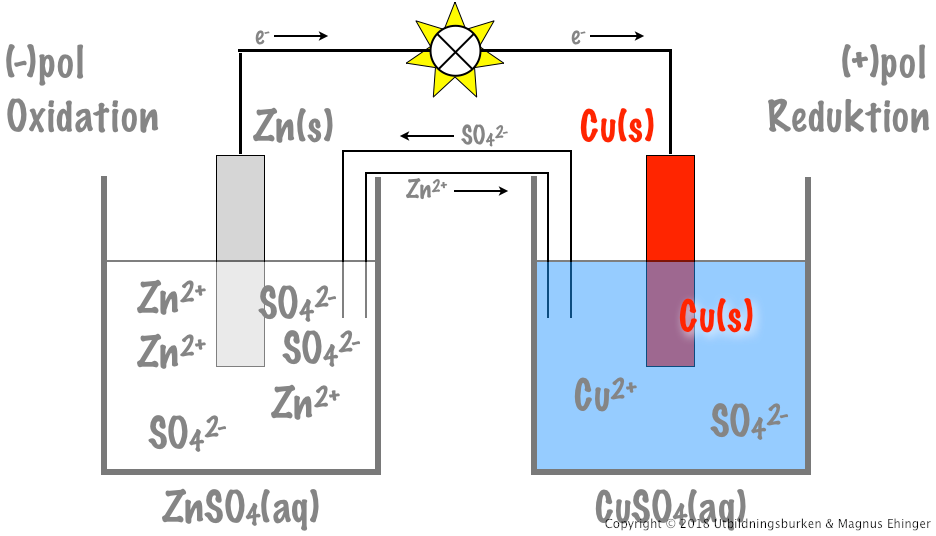
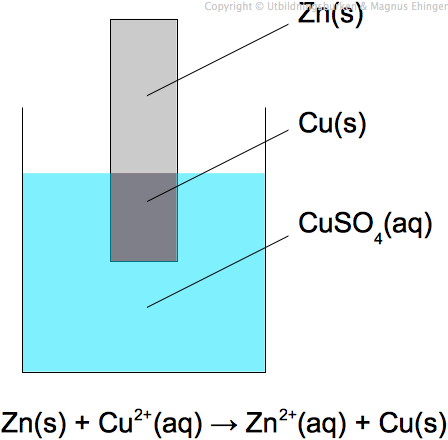
De kemiska reaktionerna som sker i ett galvaniskt element är centrala för dess funktion. Låt oss ta ett exempel med ett koppar-zink-element (Daniell-elementet):
- Anodreaktion (oxidation): $Zn(s) \rightarrow Zn^{2+}(aq) + 2e^-$
- Katodreaktion (reduktion): $Cu^{2+}(aq) + 2e^- \rightarrow Cu(s)$
- Totalreaktion: $Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)$
Denna spontana reaktion genererar en elektrisk potential, som kan mätas som spänningen mellan elektroderna.
Praktiska Tillämpningar av Galvaniska Element
Galvaniska element används i en mängd olika tillämpningar, inklusive:
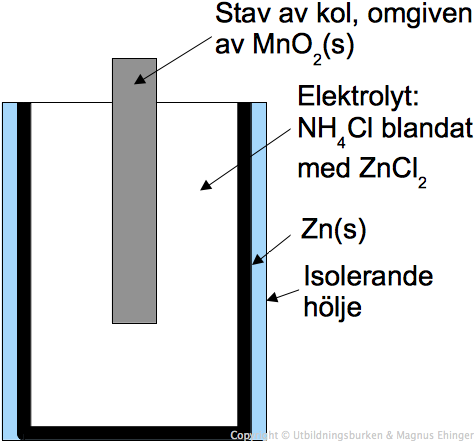
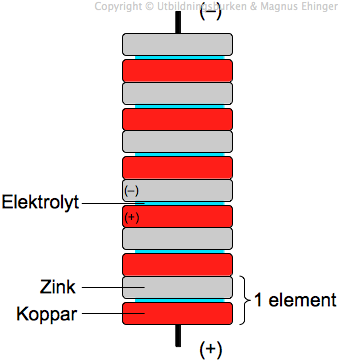
- Batterier: Allt från små knappcellsbatterier till stora bilbatterier baseras på principen om galvaniska element.
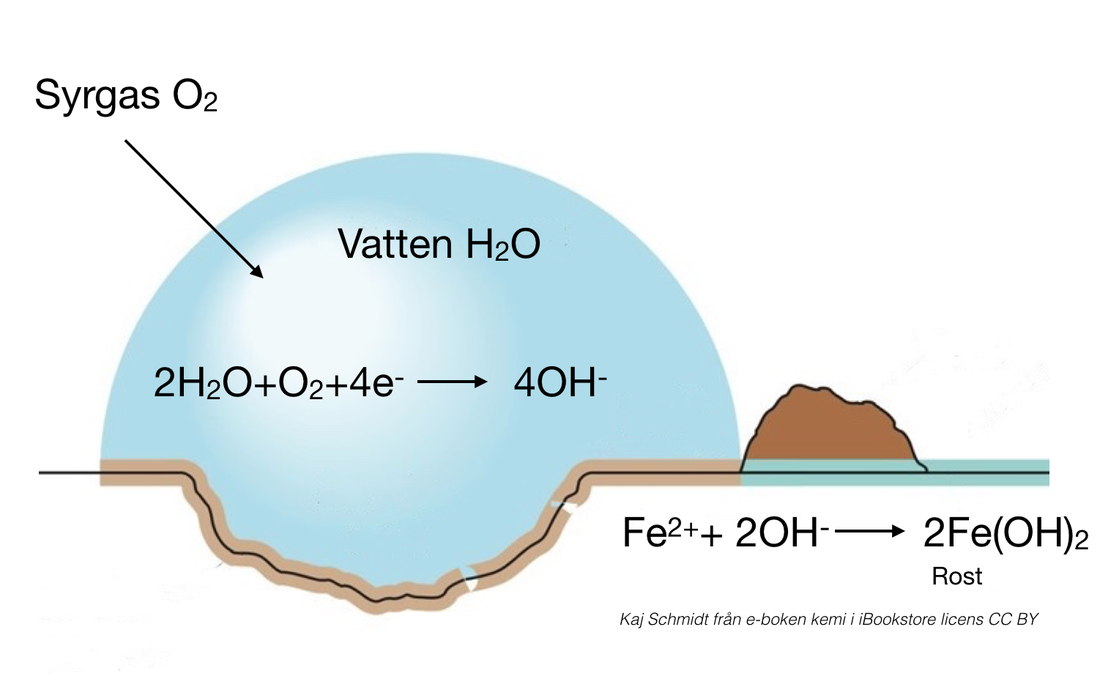
- Korrosionsskydd: Galvanisk korrosion används för att skydda metallstrukturer från rost genom att koppla dem till en mer reaktiv metall (offeranod).
- Elektrokemisk analys: Galvaniska element används i laboratoriemiljöer för att studera kemiska reaktioner och mäta elektrokemiska potentialer.
Viktiga Begrepp och Termer
För att fullt förstå galvaniska element, är det viktigt att känna till följande begrepp:
- Elektrodpotential: Den potentialskillnad som uppstår mellan en elektrod och dess elektrolyt.
- Standardpotential: Elektrodpotentialen mätt under standardförhållanden (25°C, 1 atm, 1 M lösning).
- Nernst ekvation: En ekvation som beskriver hur elektrodpotentialen varierar med koncentrationen av joner i elektrolyten.
- Elektromotorisk kraft (EMK): Den maximala potentialskillnaden mellan elektroderna i ett galvaniskt element.

Framtidens Galvaniska Element
Forskning och utveckling inom området galvaniska element fortsätter att driva fram nya och mer effektiva batteritekniker. Fokus ligger på att öka energitätheten, minska miljöpåverkan och förbättra livslängden. Framtida batterier kan baseras på nya material och elektrolyter, såsom litium-jonbatterier, bränsleceller och fasta elektrolyter.