Galvaniskt Element Teori: En Djupdykning i Kemisk Energi
Galvaniska element, även kända som voltaiska celler, är enheter som omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. Denna artikel utforskar den grundläggande galvaniska element teorin, dess komponenter, kemiska processer och praktiska tillämpningar. Vi kommer att dyka djupt in i de koncept som gör dessa element så viktiga i vår vardag.
Grundläggande Principer för Galvaniska Element
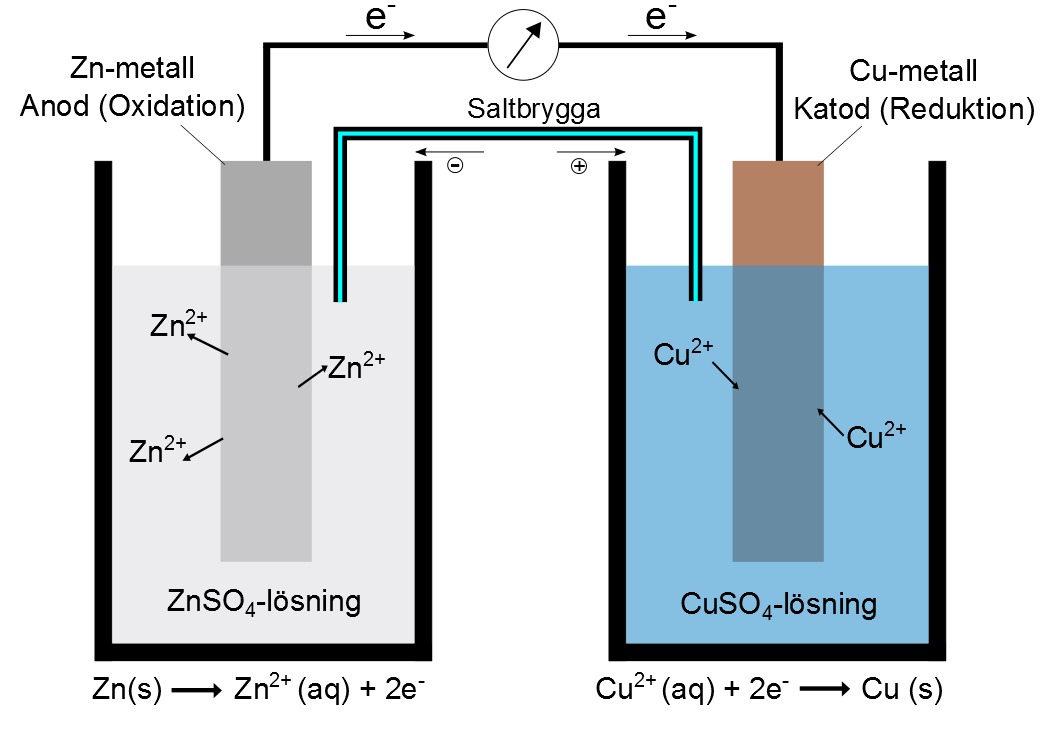
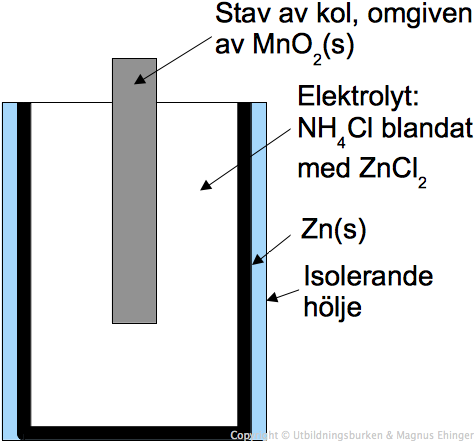
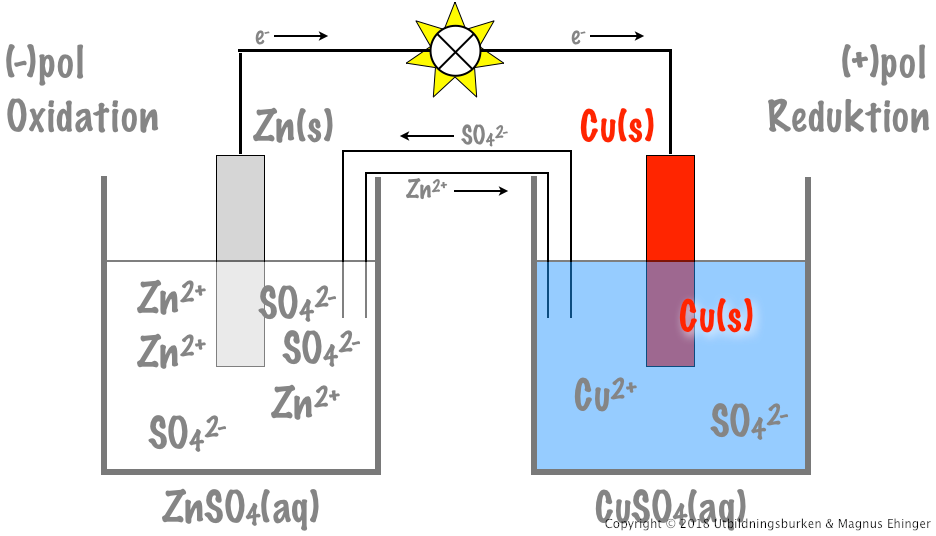
Ett galvaniskt element består av två halvceller, var och en innehållande en elektrod nedsänkt i en elektrolytlösning. Dessa halvceller är kopplade genom en saltbrygga eller en porös skiljevägg. Denna konfiguration möjliggör flödet av elektroner och joner, vilket genererar en elektrisk ström.
Halvceller och Elektroder
- Anod: Elektroden där oxidation sker. Här förlorar ett ämne elektroner.
- Katod: Elektroden där reduktion sker. Här tar ett ämne emot elektroner.
- Elektrolyt: En lösning som innehåller joner och möjliggör jonflöde.
Saltbryggan
Saltbryggan är en viktig komponent som förhindrar laddningsuppbyggnad i halvcellerna. Den innehåller en elektrolytlösning (t.ex. kaliumnitrat, KNO3) som tillåter joner att röra sig mellan halvcellerna och upprätthålla elektrisk neutralitet. Utan saltbryggan skulle reaktionen snabbt avstanna.
Kemiska Reaktioner i Galvaniska Element
Den kemiska reaktionen i ett galvaniskt element är en redoxreaktion, vilket innebär att både oxidation och reduktion sker samtidigt. Denna reaktion resulterar i en potentialskillnad mellan elektroderna, vilket driver elektronflödet.
Oxidation och Reduktion
Oxidation innebär förlust av elektroner, medan reduktion innebär upptag av elektroner. Tillsammans utgör de en redoxreaktion, som är grundläggande för funktionen av ett galvaniskt element.
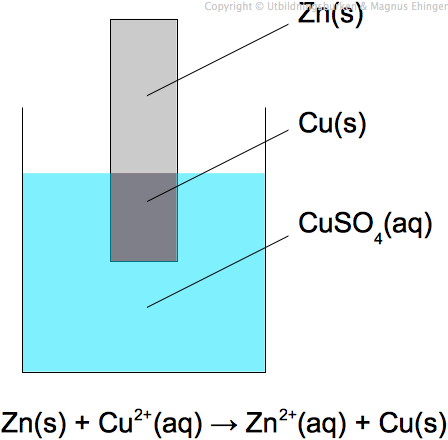
Ett exempel är Daniell-elementet, där zink oxideras vid anoden och koppar reduceras vid katoden:
- Anod (oxidation): Zn(s) → Zn2+(aq) + 2e-
- Katod (reduktion): Cu2+(aq) + 2e- → Cu(s)
Elektrodpotential och Cellpotential
Varje halvcell har en elektrodpotential, som är ett mått på dess förmåga att förlora eller ta emot elektroner. Cellpotentialen (Ecell) är skillnaden mellan katodens och anodens elektrodpotentialer. Den beräknas med formeln:
$$E_{cell} = E_{katod} – E_{anod}$$
En positiv cellpotential indikerar en spontan reaktion och därmed ett fungerande galvaniskt element.
Praktiska Tillämpningar av Galvaniska Element
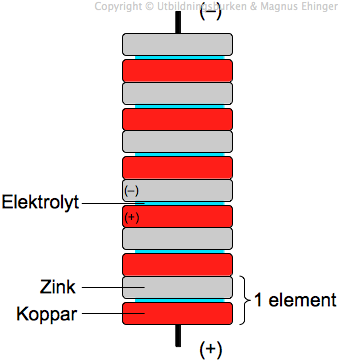
Galvaniska element används i en mängd olika applikationer, från vardagliga batterier till avancerade industriella processer.
Batterier
Batterier är de mest kända tillämpningarna av galvaniska element. De omvandlar kemisk energi till elektrisk energi för att driva allt från ficklampor till elbilar. Olika typer av batterier inkluderar:
- Alkaliska batterier: Vanliga engångsbatterier.
- Litiumjonbatterier: Uppladdningsbara batterier som används i elektroniska enheter och elbilar.
- Blybatterier: Används i bilar och andra fordon.
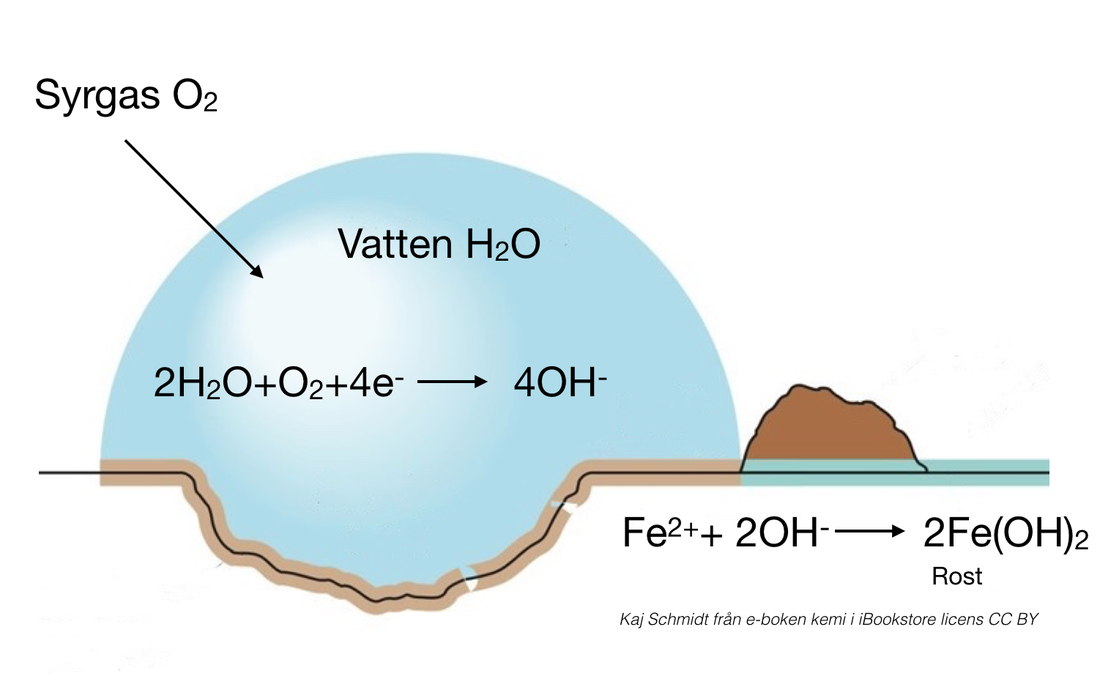
Korrosionsskydd
Galvaniska element används också för att skydda metaller från korrosion genom en process som kallas offeranod. En mer reaktiv metall (offeranod) kopplas till den metall som ska skyddas, vilket gör att offeranoden korroderar istället.
Elektrokemiska Sensorer

Galvaniska principer används i elektrokemiska sensorer för att mäta koncentrationer av olika ämnen i lösningar. Dessa sensorer är viktiga inom medicin, miljöövervakning och industriell analys.
Slutsats
Den galvaniska element teorin är grundläggande för att förstå hur kemisk energi kan omvandlas till elektrisk energi. Genom att förstå principerna bakom halvceller, redoxreaktioner och potentialskillnader kan vi uppskatta de många tillämpningar som galvaniska element har i vår moderna värld. Från batterier till korrosionsskydd, dessa element spelar en avgörande roll i tekniken och industrin.