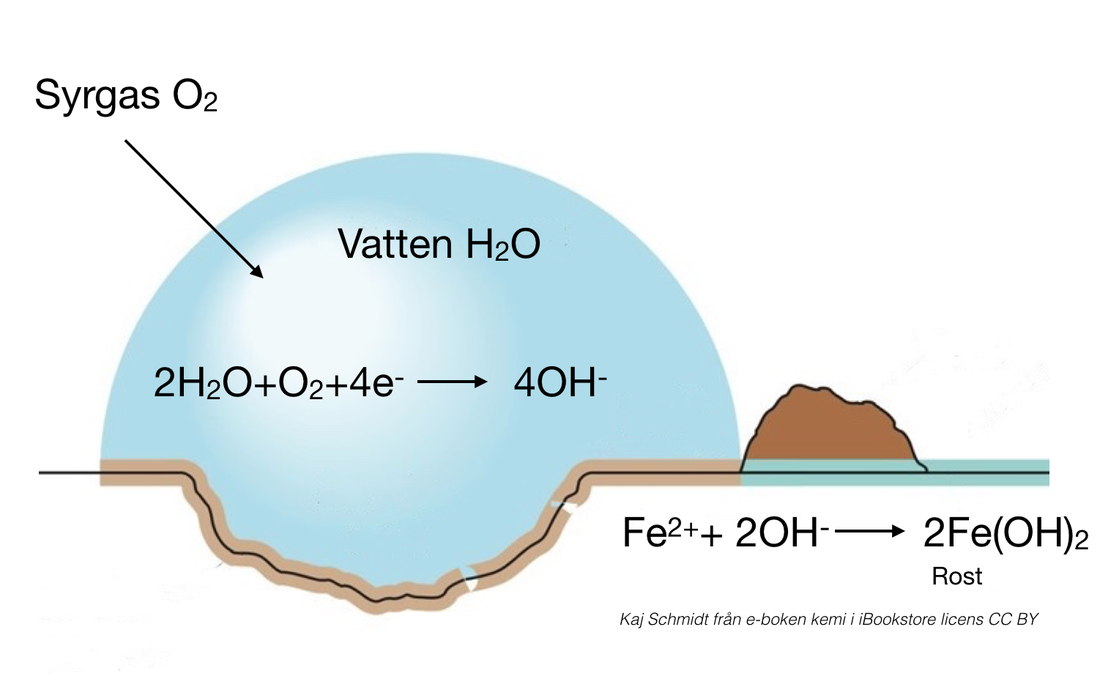
Galvanisk Cell Saltbrygga: En Djupdykning i Elektrokemi
Inom elektrokemins fascinerande värld spelar den galvaniska cellen en central roll. Denna cell, även känd som en voltaisk cell, omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. En avgörande komponent i denna process är saltbryggan, som möjliggör jonflöde och upprätthåller elektrisk neutralitet.
Vad är en Galvanisk Cell?
En galvanisk cell består av två halva celler, var och en innehållande en elektrod nedsänkt i en elektrolytlösning. Dessa halva celler är kopplade genom en saltbrygga eller en porös barriär. När en redoxreaktion sker, frigörs elektroner vid anoden (oxidation) och tas upp vid katoden (reduktion), vilket skapar en elektrisk ström.
Saltbryggans Funktion och Betydelse
Saltbryggan är en U-formad tub fylld med en elektrolytlösning, vanligtvis en inert jonförening som kaliumnitrat (KNO3) eller ammoniumnitrat (NH4NO3). Dess huvudsakliga funktioner inkluderar:
- Upprätthålla elektrisk neutralitet: När elektroner flödar från anoden till katoden, skapas en obalans av joner i elektrolytlösningarna. Saltbryggan tillåter joner att röra sig mellan de två halva cellerna, vilket neutraliserar laddningsuppbyggnaden.
- Sluta kretsen: Genom att tillhandahålla en väg för jonflöde, sluter saltbryggan den elektriska kretsen och möjliggör kontinuerlig ström.
- Förhindra blandning av elektrolyter: Saltbryggan förhindrar direkt blandning av de två elektrolytlösningarna, vilket skulle störa cellens funktion.

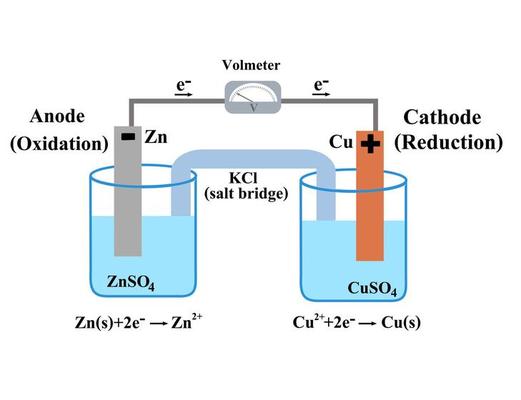
Hur Saltbryggan Fungerar i Detalj
Låt oss ta ett exempel med en koppar-zink galvanisk cell (Daniell-cell). Vid zinkanoden sker oxidation:

Zn(s) → Zn2+(aq) + 2e-
Vid kopparkatoden sker reduktion:
Cu2+(aq) + 2e- → Cu(s)
När zinkjoner (Zn2+) bildas i anodlösningen, blir den positivt laddad. Samtidigt minskar kopparjoner (Cu2+) i katodlösningen, vilket gör den negativt laddad. Saltbryggan, fylld med exempelvis KNO3, tillåter nitratjoner (NO3-) att röra sig mot anodlösningen och kaliumjoner (K+) att röra sig mot katodlösningen, vilket neutraliserar laddningsuppbyggnaden.
Praktiska Tillämpningar av Galvaniska Celler
Galvaniska celler har en mängd praktiska tillämpningar, inklusive:
- Batterier: De flesta batterier, såsom alkaliska och litiumjonbatterier, är baserade på galvaniska celler.
- Bränsleceller: Bränsleceller omvandlar kemisk energi från bränslen som vätgas till elektrisk energi.
- Korrosionsskydd: Galvanisering, en metod för att skydda metaller från korrosion, använder galvaniska cellprinciper.
- Elektrokemisk analys: Galvaniska celler används i olika elektrokemiska analysmetoder för att bestämma koncentrationer av joner i lösningar.

Vikten av Val av Saltbrygga
Valet av elektrolyt i saltbryggan är avgörande. Den bör vara inert och inte reagera med elektrolytlösningarna eller elektroderna. Dessutom bör jonerna i saltbryggan ha liknande rörlighet för att säkerställa jämn jonöverföring. Felaktigt val av saltbrygga kan leda till polarisering, minskad cellspänning och till och med skador på cellen.
Slutsats
Saltbryggan är en oumbärlig komponent i galvaniska celler, som möjliggör deras funktion genom att upprätthålla elektrisk neutralitet och sluta kretsen. Dess betydelse sträcker sig över en mängd praktiska tillämpningar, från vardagliga batterier till avancerade bränsleceller. Genom att förstå saltbryggans roll kan vi bättre uppskatta och utnyttja elektrokemins kraft.