Galvanisk Cell: En Djupdykning i Elektrokemi
Välkommen till en omfattande utforskning av den galvaniska cellen, en grundläggande komponent inom elektrokemin. Denna artikel kommer att guida dig genom de intrikata detaljerna kring hur dessa celler omvandlar kemisk energi till elektrisk energi, och deras betydelse i vår vardag.
Vad är en Galvanisk Cell?
En galvanisk cell, även känd som en voltaisk cell, är en elektrokemisk enhet som genererar elektrisk ström genom en spontan redoxreaktion. Denna reaktion innebär överföring av elektroner mellan två olika ämnen, vilket skapar en potentialskillnad som kan driva en extern krets.
Komponenter i en Galvanisk Cell
En typisk galvanisk cell består av följande nyckelkomponenter:
- Anod: Elektroden där oxidation sker. Här förlorar ett ämne elektroner.
- Katod: Elektroden där reduktion sker. Här tar ett ämne emot elektroner.
- Elektrolyt: En lösning som innehåller joner och möjliggör jonvandring mellan elektroderna.
- Saltbrygga: En anordning som förhindrar laddningsuppbyggnad och upprätthåller elektrisk neutralitet i cellen.
- Ledare: En extern krets som kopplar samman elektroderna och möjliggör elektronflöde.


Den Elektrokemiska Processen
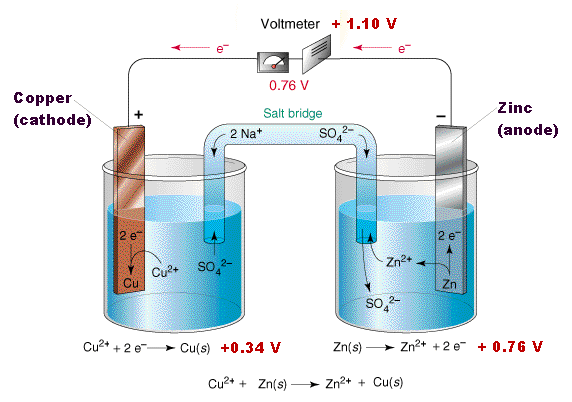
Den grundläggande principen bakom en galvanisk cell är redoxreaktionen. Låt oss ta ett exempel med en koppar-zink-cell (Daniellcellen):
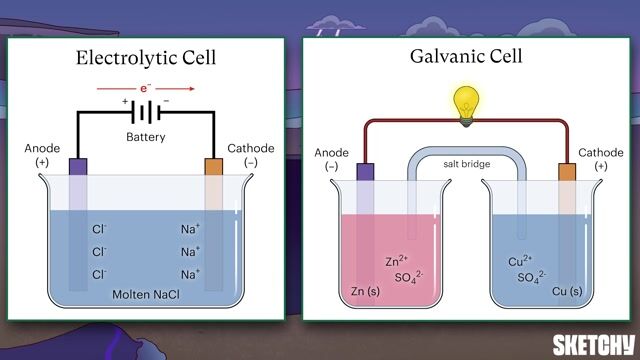
- Oxidation vid Anoden: Zinkatomen (Zn) förlorar två elektroner och blir en zinkjon (Zn2+): Zn → Zn2+ + 2e-
- Reduktion vid Katoden: Kopparjonerna (Cu2+) tar emot två elektroner och blir kopparatomer (Cu): Cu2+ + 2e- → Cu
- Jonvandring: Saltbryggan, ofta fylld med en elektrolyt som kaliumnitrat (KNO3), tillåter jonvandring för att balansera laddningarna. Nitratjoner (NO3-) rör sig mot anoden, och kaliumjoner (K+) rör sig mot katoden.
- Elektronflöde: Elektronerna som frigörs vid anoden flödar genom en extern krets till katoden, vilket skapar en elektrisk ström.
Användningsområden för Galvaniska Celler
Galvaniska celler är grundläggande för många teknologier och applikationer, inklusive:

- Batterier: Allt från små knappcellsbatterier till stora bilbatterier använder principen om galvaniska celler.
- Elektroplätering: Används för att belägga metallföremål med ett tunt lager av en annan metall.
- Korrosionsskydd: Galvaniska celler kan användas för att skydda metallstrukturer från korrosion genom att tillhandahålla en offeranod.
- Bränsleceller: Används i vissa fordon och stationära applikationer för att generera elektricitet från kemiska bränslen.
Vikten av Elektrolyten
Elektrolyten spelar en avgörande roll i en galvanisk cell. Den måste vara en bra ledare av joner, men får inte reagera med elektroderna. Valet av elektrolyt påverkar cellens potential och prestanda. En stark elektrolyt, som en lösning av ett salt, syra eller bas, är ofta nödvändig för att upprätthålla en effektiv jonvandring.
Saltbryggans Funktion
Saltbryggan är en nyckelkomponent som säkerställer att laddningsbalansen upprätthålls i cellen. Utan en saltbrygga skulle laddningsuppbyggnad snabbt stoppa reaktionen. Saltbryggan tillhandahåller en väg för jonvandring utan att blanda de två elektrolytlösningarna.
Framtiden för Galvaniska Celler
Forskning och utveckling inom galvaniska celler fortsätter att driva innovation inom batteriteknologi och energilagring. Nya material och konstruktioner undersöks för att öka effektiviteten, minska kostnaderna och förbättra hållbarheten. Framtida galvaniska celler kan spela en nyckelroll i övergången till en mer hållbar energiframtid.
Genom att förstå de grundläggande principerna bakom galvaniska celler kan vi bättre uppskatta deras betydelse och potential i vår teknologiska värld. Denna kunskap är avgörande för att driva framsteg inom elektrokemi och energilagring.