Galvanisk Cell Förklaring: Allt Du Behöver Veta

Vad är en Galvanisk Cell?
En galvanisk cell, även känd som en voltaisk cell, är en elektrokemisk anordning som omvandlar kemisk energi till elektrisk energi genom spontana redoxreaktioner. Denna process är grundläggande för många av de batterier vi använder i vår vardag.
Grundläggande Komponenter
För att förstå hur en galvanisk cell fungerar, är det viktigt att känna till dess grundläggande komponenter:

- Anod: Den elektrod där oxidation sker. Här förlorar ett ämne elektroner.
- Katod: Den elektrod där reduktion sker. Här tar ett ämne emot elektroner.
- Elektrolyt: En lösning som innehåller joner och möjliggör jonvandring mellan elektroderna.
- Saltbrygga: En anordning som förbinder de två elektrolytlösningarna och upprätthåller elektrisk neutralitet genom att tillåta jonvandring.
- Yttre krets: En ledare som förbinder anoden och katoden och tillåter elektroner att flöda, vilket skapar en elektrisk ström.
Redoxreaktioner i en Galvanisk Cell
Processen som driver en galvanisk cell är en redoxreaktion, vilket innebär att både oxidation och reduktion sker samtidigt. I anoden sker oxidation, där ett ämne förlorar elektroner och ökar sitt oxidationstal. I katoden sker reduktion, där ett annat ämne tar emot elektroner och minskar sitt oxidationstal.
Daniellcellen: Ett Klassiskt Exempel
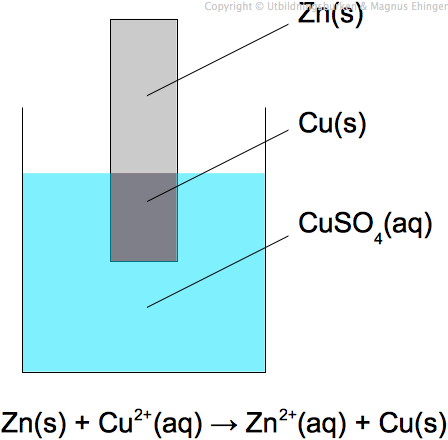
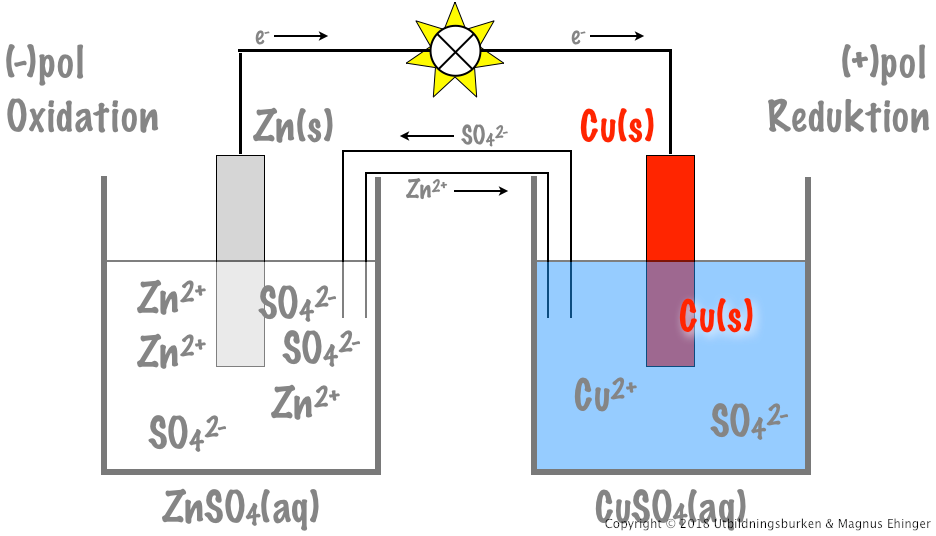
En av de mest kända galvaniska cellerna är Daniellcellen, som består av en zinkelektrod i en zinksulfatlösning och en kopparelektrod i en kopparsulfatlösning. Reaktionen som sker är:
$$Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)$$

I denna reaktion oxideras zink till zinkjoner vid anoden, medan kopparjoner reduceras till koppar vid katoden. Saltbryggan, vanligtvis fylld med kaliumnitrat, upprätthåller elektrisk neutralitet genom att tillåta nitratjoner att flöda till anoden och kaliumjoner till katoden.
Praktiska Tillämpningar av Galvaniska Celler
Galvaniska celler har en mängd praktiska tillämpningar, främst i form av batterier. Här är några exempel:
- Alkalinebatterier: Används i vardagliga enheter som fjärrkontroller och leksaker.
- Litiumjonbatterier: Används i mobiltelefoner, bärbara datorer och elbilar på grund av deras höga energitäthet.
- Bilbatterier (bly-syra): Används för att starta motorer och driva elektriska system i bilar.

Utvecklingen av nya och mer effektiva galvaniska celler är ett aktivt forskningsområde, med fokus på att öka energitätheten, minska miljöpåverkan och förbättra livslängden.
Viktiga Termer och Begrepp
För att ytterligare förstå galvaniska celler, är det viktigt att känna till följande termer:
- Elektrodpotential: Ett mått på en elektrods förmåga att förlora eller ta emot elektroner.
- Cellpotential: Skillnaden i elektrodpotential mellan anoden och katoden, vilket bestämmer cellens spänning.
- Elektromotorisk kraft (EMK): Den maximala potentialskillnaden som en cell kan generera.
- Nernst ekvation: Används för att beräkna cellpotentialen under icke-standardförhållanden.
Genom att förstå dessa begrepp kan man bättre analysera och förutsäga beteendet hos galvaniska celler i olika tillämpningar.
Slutsats
Galvaniska celler är en fascinerande och viktig del av vår teknikdrivna värld. Genom att omvandla kemisk energi till elektrisk energi, möjliggör de en mängd olika applikationer, från vardagliga batterier till avancerade energilagringssystem. Genom att förstå de grundläggande principerna bakom galvaniska celler kan vi bättre uppskatta deras betydelse och fortsätta att utveckla mer effektiva och hållbara energilösningar. Förhoppningsvis har denna djupgående förklaring gett dig en klar och tydlig förståelse för detta viktiga ämne.